材料科学基础专题 --- 钻石(金刚石)/石墨的绝缘性与硬度差异
在讨论钻石 (金刚石)与石墨的性质前,我们必需要了解其键结。
钻石与石墨都是与碳为构成元素的材料,每一个碳会与相邻的碳各出一颗电子,
形成坚强的「共价键」Covalent Bond。
大学的普通化学则会进一步提到「电子云」的概念,
此后就要习惯将共价键视为电子云的重叠。
而如果碳原子的周围都有四个碳,那就会成为饱和的「八隅体」结构,
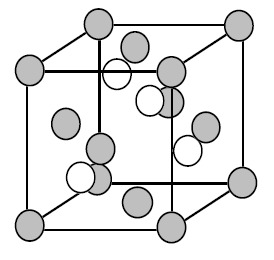
在钻石的晶体结构中,每一个碳的周围都有四个碳相邻,
使他拥有饱和的sp3 混成轨域键结,在庞大的晶体结构中形成所谓「网状共价键」,
所有的电子态 (electron state)都是填满的,因此键结间没有电子会跑来跑去,
因此想要导电,需要很高的活化能让价电子被激发到激发态,
这种能量是常温下无法获得,所以钻石在常温下是绝缘体。
至于钻石的硬度,也与其键结有很大关系。由于所有的键都饱和,
价电子的重组相当困难,所以碳原子之间的移动也变得非常困难,
因此让钻石有很高的硬度。
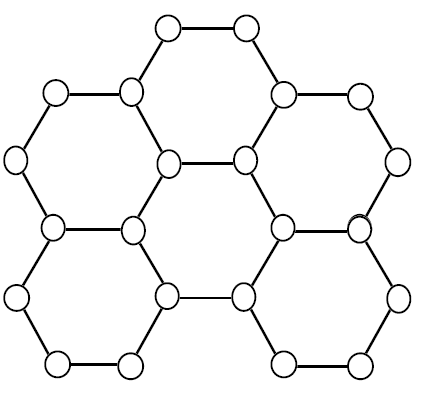
石墨的结构则是一层又一层的碳平面互相堆叠,碳平面之间以凡得瓦力维持连结,
由下图可以注意到,一个碳原子只和其它三个碳原子相邻,
所以他有一个键结是不饱和的,因此石墨在单层的范围内具有导电性,
不过如果是垂直于层的方向,那导电性就很差了。
层与层之间微弱的键结也使其容易滑动,就好像两张纸牌一样,
因此石墨就不如钻石这般难切割了。
这种容易剥离的层状结构,后来引致了世纪大发现: 用胶带就能撕出石墨烯 !
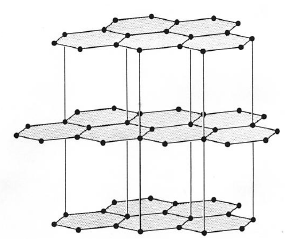
而对于车迷、航空迷来说,有一种耳熟能详的材料: 碳纤维,其实和石墨是非常相似,
它同样是碳以六角型相邻的层状排列,但却拥有很强的机械性质,
原因是,相较于石墨的层状结构相对上整齐排列,
我们可以想像成碳纤维就像是我们把石墨给卷起来,层与层之间的排列变得不规则,
反而使其很难滑移,因此机械性质便即为坚韧了。